リウマチ外来について
関節リウマチ(Rheumatoid Arthritis)は自己免疫疾患の一つで、全国で患者数が70万〜80万人と推定され、いわゆるリウマチ性疾患の中でもっとも患者数が多い疾患です。男女比は1対4と女性に多く、働き盛りの30〜50歳代が発症のピークと考えられていますが、近年60歳以降の高齢発症患者さんが増加傾向となっています。関節リウマチは発症早期から関節破壊が始まり、最初の1~2年が関節破壊の進行が最も早くなることが分かっています。従って早期に診断し、早期に治療を開始することが最も重要になっています。近年関節リウマチの治療薬である生物学的製剤が多数上市され、完全寛解が期待できる疾患となっています。当院ではリウマチ専門医と指導医が中心となり、内科と整形外科、リハビリテーション科が連携してリウマチ診療を行っています。
担当医
常勤 久米田 靖郎 日本リウマチ学会専門医・指導医
非常勤 稲葉 雅章 日本リウマチ学会専門医
非常勤 和田 嗣憲 日本リウマチ学会専門医
リウマチについて
関節リウマチ患者(内科・整形外科)年度別推移
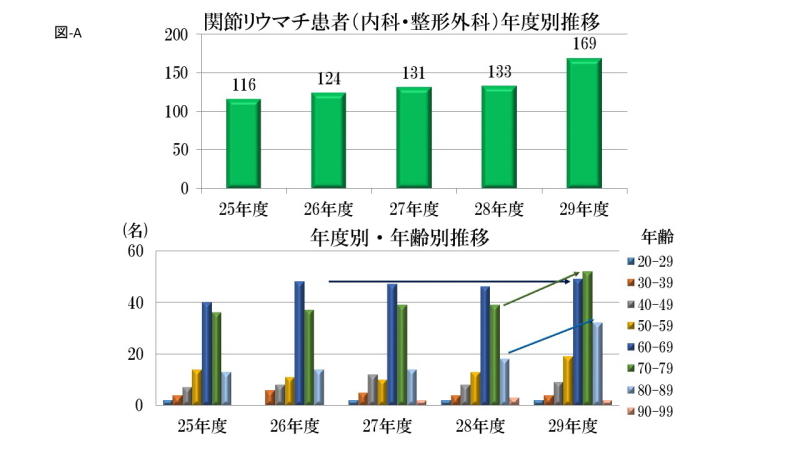
当院におけるRA患者数の推移と年齢分布をお示ししたものです。内科と整形外科で加療中のRA患者さんは、徐々に増えており、平成29年度で169名となっています。 年度別・年齢別分布では60歳代が年度毎横ばい傾向にある反面、70歳台以上では増加傾向となっています。RA患者さんが高齢化しているのがわかります。
当院における生物学的製剤の使用状況
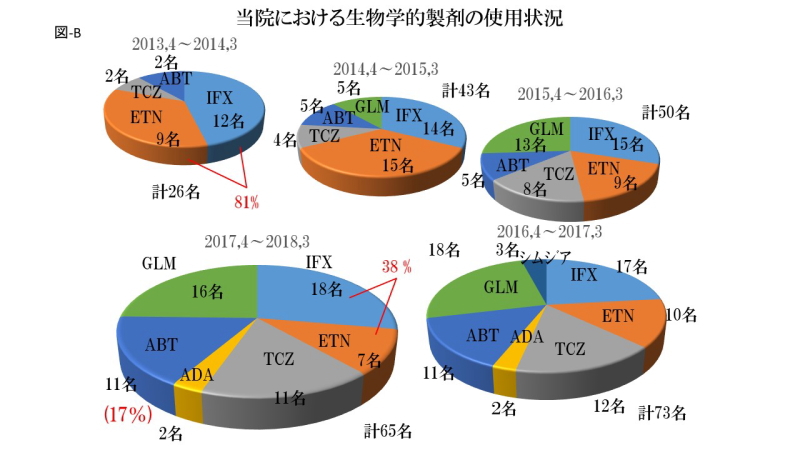
当院における生物学的製剤の使用状況ですが、2013年はIFXとETNが全体の81%を占めていましたが、その後徐々にこの2者以外のBioがつかわれるようになり、2017年ではIFXとETNが全体の38%と減少、ABTやTCZといった抗TNF-α製剤以外の製剤の使用頻度が増えています。また抗TNF-α製剤ではGLMが全体の25%と最も多く使用されています。
関節リウマチの病態
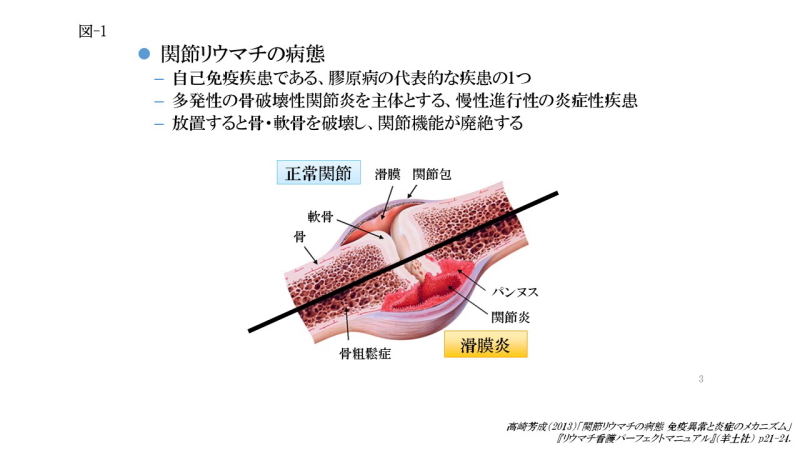
関節リウマチは免疫の異常により関節を構成している滑膜という組織に持続的な炎症がおこる代表的な自己免疫疾患の一つで、典型的には手の指や足の指などの小さい関節に左右対称性に関節炎がおこりますが、膝などの大きな関節が侵されることもあります。
関節リウマチの発症
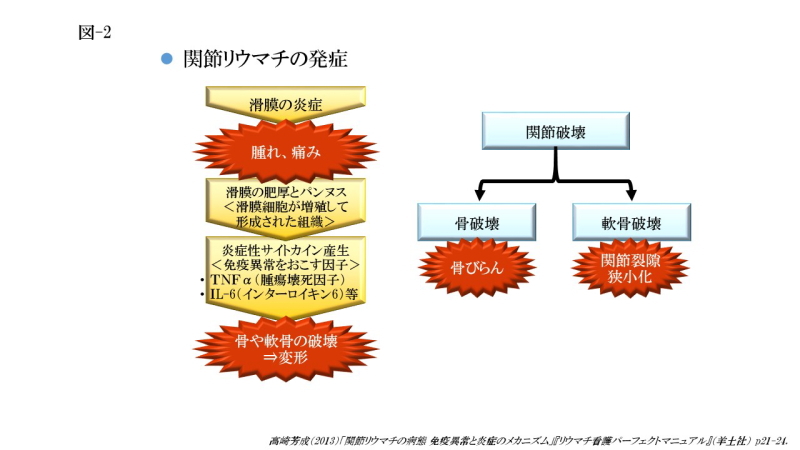
関節リウマチが発症すると自己の関節組織に対して自己免疫応答が起こります。まず、主病変部となる関節を包む滑膜に炎症が起こり、血管新生やリンパ球、マクロファージなどの炎症系細胞がみられます。そして、滑膜炎が慢性化すると滑膜が増殖します。この増殖した滑膜をパンヌスと呼びます。パンヌスには、様々な免疫細胞(T細胞、B細胞、マクロファージ、樹状細胞、形質細胞等)が浸潤しており、これらの細胞はTNFα(ティーエヌエフ アルファ)、IL(インターロイキン)-1、IL-6等の炎症性サイトカインと呼ばれる、炎症反応を促す体内物質を大量に産生するようになります。これらの炎症性サイトカインは蛋白分解酵素や破骨細胞を分化・誘導するため、関節は慢性炎症を発生して骨・軟骨などの組織損傷を引き起こします。パンヌスにより関節軟骨と、関節を包む滑膜や軟骨に覆われていない骨が破壊されると、X線写真では骨皮質(骨の外側の硬い部分)の不連続像として撮影されます。これは骨糜爛と呼ばれ、関節リウマチにおける骨破壊の代表的な所見です。また、軟骨の消失は、X線写真で関節裂隙の狭小化(関節のすき間が狭くなること)として撮影されます。関節裂隙の狭小化が進むと、露出した骨と骨が擦れて「きしみ音」として捉えられることもあります。その状態で放置すると関節は変形し、骨同志の癒合をおこして関節機能が障害され、廃絶していきます。
また痛みのある関節を動かさなくなることで関節の動く範囲が狭くなったり、さらに進行すると強直といって関節がひとかたまりの骨となって動かなくなったりすることもあります。朝のこわばりも特徴的で、朝の起床時には手を握れず、衣服の着脱などの朝の身支度が困難になるなど日常生活に支障を来たすようになります。また全身倦怠感や易疲労感を持つことも特徴の一つです。さらに、血管炎をはじめとする関節外症状や内臓障害を認め、難治性もしくは重篤な臨床病態を伴う場合を、「悪性関節リウマチ」と定義しています。悪性関節リウマチは特定疾患に認定されています。薬物療法でしっかり炎症を抑えないと軟骨の破壊と骨の糜爛がおこり、外観上も尺側偏位、スワンネック変形、ボタン穴変形、高度外反母趾などの特徴的な形を呈するようになり、最終的に関節機能が廃絶します。
関節リウマチの自然経過にはいくつかのパターンがあると考えられており、病期が発症して短期間で多くの関節の破壊が進む患者さんもいれば、初期だけ症状があり1−2年で自然と寛解にいたる患者さんもいますが、多くは症状が良くなったり悪くなったりを繰り返しながら徐々に関節破壊が進行していきます。しかし最近の治療薬や治療法の進歩により、早期に診断して治療を開始できれば、多くの患者さんで病期の進行を最小限に食い止められるようになってきています。
関節リウマチの原因は完全にはわかっていませんが、遺伝性があることは確実で、HLA(Human Leukocyte Antigen, ヒト白血球抗原)領域をはじめこれまでに100以上の疾患の発症に関わる遺伝子が明らかになっています。また喫煙や歯周病もリウマチの発症や進行に関与していることは確実で、遺伝的な体質に環境要因が重なって免疫機能に異常が生じ発症すると考えられています。
関節リウマチの症状
関節リウマチの症状は、主病変部である関節症状と、それ以外の関節外症状に分けられます。
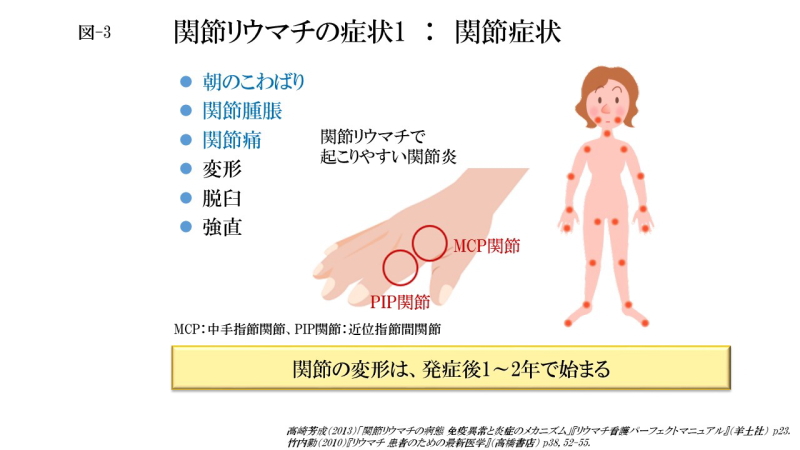
関節症状の特徴は多発性、対称性の関節の腫れと痛みです。特に手指と手関節に好発します。初発症状として、手指、特に近位指節間関節(PIP)と中手指節関節(MCP)、および手関節の腫れと痛み、朝のこわばり、筋力低下があげられます。
滑膜や軟骨の破壊が進行すると変形や脱臼がおこり、最後には骨と骨が引っ付いて「強直」という状態になります。関節の変形は発症後1~2年で始まるといわれており、そうならないために早期の発見と治療が重要です。
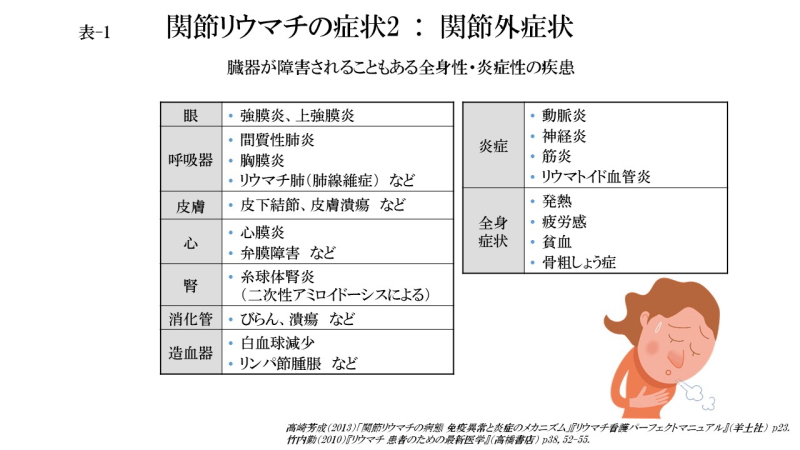
関節リウマチは全身の結合組織やそこに分布する血管も炎症の場となります。そのため関節だけではなく、他の臓器にも症状があらわれていないか全身を観察する必要があります。貧血や骨粗鬆症は多くの患者さんに現れる関節リウマチの関節外症状です。
関節リウマチの診断
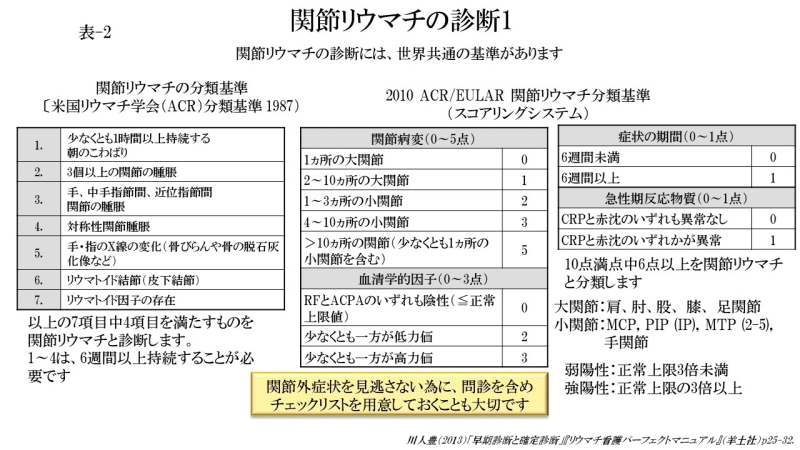
現在の関節リウマチの診断は、ACR/EULARの関節リウマチ分類基準が用いられます。この診断基準は、ACR(米国リウマチ学会)とEULAR(欧州リウマチ学会議)が共同で2010年に発表したもので、診察時に認められる持続性滑膜炎のうち、今後「びらん性滑膜炎」に進展する可能性の高いものを関節リウマチに分類する基準であるため、「分類基準」としています。この診断基準は、できる限り早期に関節リウマチを診断するための基準で、それまで使用されていたACR基準(1987年改訂)とは違う目的で使用されます。
ACR分類基準は、1987年にACRが改訂した関節リウマチ分類基準で、「ACR基準」とも呼ばれています。この基準は、臨床症状や臨床検査、画像診断などを組み合わせて、リウマチ疾患から「完成した関節リウマチ」を分類する目的で長い間使用されてきました。罹病期間の長い関節リウマチ患者さんのほとんどはこの基準にあてはまりますが、発病後間もない発症早期の患者さんにはあてはまらない場合が多いため、ACR/EULARの関節リウマチ分類基準が作成されました。

関節リウマチにおける画像診断は、早期診断に重要です。発症早期で、患者さんに自覚症状がない場合でも、画像診断により関節の腫脹やその周囲の変化などから炎症の程度を判断できます。
単純X線撮影は、通常では手の写真を撮影しますが、手以外に症状の訴えがあれば、その部位の撮影が行われます。X線写真では、滑膜の炎症による関節周囲の軟部組織の腫脹、関節裂隙挟少化(骨と骨の間隔が狭くなった状態)、骨萎縮(骨が薄く映る)、そして骨破壊像(「骨びらん」と呼ばれ、関節リウマチ特有の変化)が読影でき、骨関節破壊の進行の判定に有用です。
超音波検査(関節エコー)は、非侵襲的な検査法であり、簡便、安価、動態的、リアルタイムに診断可能などの利点があります。
関節エコーでは軟部組織が明瞭に描出できます。また、組織内の微細な新生血管が、パワードプラシグナルとして肥厚した滑膜に一致して認められます。この評価法は、関節腔内スコアリングが標準化委員会のガイドラインが示されています。さらに、骨びらんを描出することができます。
MRI検査は、炎症性滑膜、パンヌスや骨軟骨の破壊をよく描出することができ、単純X線写真では描出できなかった小さな骨びらんも評価できるようになり、早期診断に有用です。特に、滑膜炎のような軟部病変の検出にはMRIが主力となります。
CT検査は、単純X線写真に比べて、ごく早期の骨びらんを抽出することが可能です。また、従来の単純X線写真では判読不能であった上位頸椎病変、特に椎間関節の初期病変を捉えることができます。さらに、重篤な合併症である肺線維症の初期病変を捉えるために必要不可欠の検査です。

関節リウマチの診断に用いられる血液検査として、自己抗体であるRF、抗CCP抗体、ANAや滑膜由来のMMP-3等があります。
リウマトイド因子(RF):IgG分子のFc部分に反応する自己抗体の一種で、通常はIgMクラスのRFが測定されます。関節リウマチ患者さんの約80%が陽性になりますが、他の膠原病や慢性肝疾患、慢性感染症、蛋白異常症などでも陽性となるため診断的特異性は低いとされます。同一患者さんにおいて、疾患活動性との相関がある程度みられ、治療の経過の追跡に使われることがあります。
抗環状シトルリン化ペプチド抗体(抗CCP抗体):関節リウマチに疾患特異性が高い検査で、感度および特異度ともに高いと報告されています。また、抗CCP抗体陽性の早期関節リウマチ患者さんは、将来的に関節破壊が進行することが示されており、ACR/EULARの新分類基準にもRFとともに測定項目として含まれています。
マトリックスメタロプロテナーゼ3(MMP-3):MMP-3は滑膜由来の蛋白分解酵素で、細胞外マトリックスを分解し、関節破壊に深くかかわる物質です。早期関節リウマチの診断に用いられ、関節破壊の予後予測に有用とする報告もあります。
抗核抗体(ANA):様々な細胞核成分と反応する自己抗体の総称で、膠原病の一次スクリーニング検査として必ず行われる検査です。膠原病では広く陽性になるため、膠原病であることを判断するために行われる検査であり、特定の疾患の診断やフォローアップには適していません。
関節破壊の評価

骨、関節の構造的変化の進行度を判定する指標として、一般的にSteinbrocker(スタインブロッカー)病期分類が用いられます。各StageはX線所見を中心に判定されます。
各ステージを簡略化すると、強直があればStage IV、変形・亜脱臼があればStage III、骨破壊像があればStage II、これらのいずれもなければStage Iになります。
なお、判定には最も進行した関節の状態が評価されるため、全体的な病変の進行を反映しているとは限りません。

関節構造の破壊の進行度を評価するもう一つの基準として、Larsen(ラーセン)の病期分類があります。Larsenの病期分類も関節リウマチ患者の関節破壊の程度をX線で評価する方法で、手術時期の決定など治療方針の決定に用いられます。関節リウマチは慢性かつ進行性であることから、定期的にX線撮影をして、過去の画像と比較することが大切です。
関節リウマチの治療

関節リウマチの治療目標は、リウマチ関節診療ガイドライン2014において、「臨床症状の改善のみならず、関節破壊の抑制を介して長期予後の改善、特に身体機能障害の防止と生命予後の改善を目指す。」と示されています。これは、関節リウマチ診療が飛躍的に進歩したため、現在の治療手段によって臨床症状を改善し、関節破壊の進行を防止することができるようになったことから設定されました。
そのための治療戦略として、①関節炎をできるだけ速やかに鎮静化させて寛解に導入し、寛解を長期間維持する、②合併病態の適切な管理と薬剤の適正使用によって有害事象の発現を予防あるいは低減し、生じた場合には適切に対応する、③関節破壊に起因する機能障害を生じた場合には、適切な外科的処置を検討する、④最新の医療情報の習得に努め、日常診療に最大限適用する、ことを推奨しています。また、治療法の選択について、⑤患者と情報を共有し、協同的意思決定(shared decision making)を行う、ことにも言及しています。
関節リウマチ治療の種類には、薬物療法、手術療法、リハビリテーション、基礎療法の4本柱があります。
手術療法は、関節リウマチが進行し、関節痛の改善、関節機能や日常生活動作(ADL)の改善、活動性のコントロールを主な目的として施行します。特に、上肢の手術はADLを改善して、身の回りの動作や社会的活動が行えることを目標に、下肢の手術は歩行機能の回復を目的とし、リハビリテーション療法につなげてQOLの改善を目標にします。
手術の種類には、人工関節置換術、滑膜切除術、関節固定術、関節形成術、腱再建術、その他(頸椎固定術、腱移行術など)があります。
リハビリテーションには理学療法(物理療法、運動療法)、作業療法、装具療法があり、変形・破壊した関節の働きをできるだけ動かせるように訓練して、社会活動ができるように、また将来おこりうる障害の予防を目的とします。
関節リウマチに対する理学療法の目的は、消炎および鎮痛、運動機能(関節の可動域や筋力)の維持あるいは改善、変形の予防あるいは矯正です。作業療法は、ADL基本動作を改善し、家庭や職場に復帰してQOL向上を目的とします。装具療法は関節の安静を保ち、関節をうまく支え、あるいはADLの介助や関節の変形予防・矯正などを目的に、様々な装具を使用します。
基礎療法は、毎日の 暮らしの中において留意すべきポイントを守って生活する治療法で、例えば、体調を保つために十分に睡眠時間をとる、あるいは疾患活動性に応じて安静にする、関節を保護するような生活を送る、などを適切に指導することが重要です。
関節リウマチの薬物治療

薬物療法には主に、非ステロイド性抗炎症薬(NSAIDs)、ステロイド薬、抗リウマチ薬が使用されます。抗リウマチ薬には免疫調節薬、免疫抑制薬、生物学的製剤、JAK(ジャック)阻害薬があり、それぞれ関節リウマチの原因を改善することから、疾患修飾性抗リウマチ薬(disease-modifying anti-rheumatic drugs:DMARDs)と呼ばれています。
今日の治療戦略は、関節リウマチの診断後できるだけ早い時期から、メトトレキサートを中心とした従来型DMARDsと呼ばれる免疫調節薬や免疫抑制薬を投与し、痛みが強い場合には対症療法としてNSAIDsを、あるいは疾患活動性が十分に抑えられない場合には短期間の低用量ステロイドを併用することがあります。ただし、ステロイドは副作用の面から、NSAIDsも対症療法でかつ消化管障害の面から、できるだけ早期に中止することが好ましいとされています。
そして、従来型DMARDsで十分な効果が得られない場合には生物学的製剤が使用されます。生物学的製剤は、その登場前まで難しいとされていた寛解導入が可能な薬剤で、高い治療効果が期待されます。ただし、重篤な副作用が発現する可能性もあり、投与中には十分な注意が必要です。
JAK阻害薬であるトファシチニブは、サイトカインによる細胞内シグナル伝達を阻害し、最終的に炎症性サイトカインの産生を抑制する薬剤です。
抗リウマチ薬による治療戦略は、6カ月以内に寛解を達成することが目的ですが、投与開始から3カ月後までに何らかの改善がみられなければ、治療を見直す必要があります。
関節リウマチ治療の基本は薬物療法です。かつては抗炎症剤(ステロイド剤、非ステロイド剤)と金製剤が治療の中心でしたが、1990年代に入ってからこれまでの30年間で多くの新しい抗リウマチ薬やさまざまな治療法が開発されました。特に1999年にリウマトレックス®が関節リウマチに使えるようになり(16mg/週までの増量が承認)、抗リウマチ薬の中ではリウマトレックス®が最も使われるようになりました。
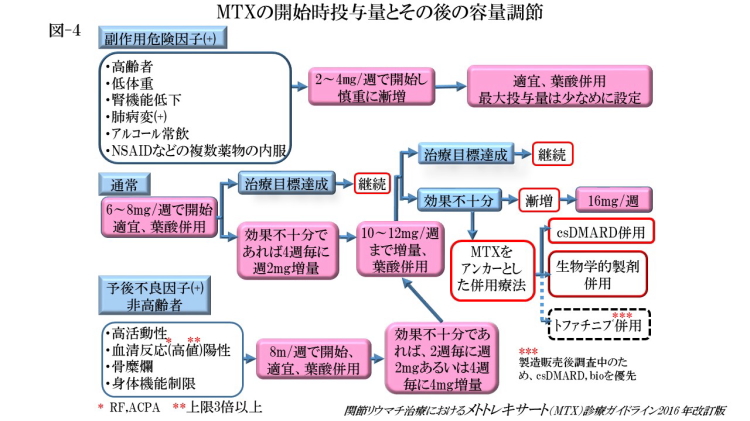
MTXの開始時投与量は原則6~8 mg/ 週で経口投与を開始します。開始時投与量は副作用危険因子や疾患活動性,予後不良因子を考慮して決定します。特に,予後不良因子をもつ非高齢者では8 mg/週で開始することが勧められます。
低用量で治療開始が勧められる症例は
1,高齢者,2,低体重,3,腎機能低下症例,4,肺病変を有する例,5,アルコール常飲者,6, NSAID 複数内服例です。2〜4 mg/週で開始し、慎重に漸増します。適宜、葉酸を併用し、最大容量が少なめに設定します。
増量および用量の調節と最大投与量は6~8㎎/週で開始した場合、治療目標を達成した場合そのまま継続しますが、MTX治療開始後4週間経過しても治療目標に達しない場合は増量します。通常,増量は4週ごとに1 回に週2mgずつ行ないます。
高疾患活動性,予後不良因子をもつ非高齢者では2週ごとに週2mg、あるいは4週ごとに週4mgずつ迅速に増量してもよいとされています。
副作用危険因子がなく,忍容性に問題なければ10~12mg/週まで増量します.それで治療目標を達成すれば継続し、効果が不十分であれば,最大16mg/週まで漸増することができますが,他の従来型合成抗リウマチ薬や生物学的製剤の併用を考慮してもよいとされています。
MTXの投与方法は1週間あたりのMTX投与量を1回または2~3回に分割して,12時間間隔で1~2日間かけて経口投与します。1週間あたりの全量を1回投与することも可能でありますが、8mg/週を超えて投与するときは、分割投与が望ましいとされています。

MTXの禁忌と慎重投与の症例は、白血球3000未満、血小板5万未満では禁忌、また高齢者で頻度が高い腎機能障害についてはeGFR<30mL/分/1.73m2では禁忌、eGFR<60mL/ 分/1.73m2 では葉酸を併用しながら低用量より慎重投与となっています。

MTX 慎重投与に相当する患者とその対応については、65 歳以上の高齢者、潜在性結核感染症が疑われる例、ニューモシスチス肺炎の発症リスクが高いと判断される例があげられます。また、肝炎ウイルス感染の可能性のある方は、MTX投与前に治療を行う必要があります。
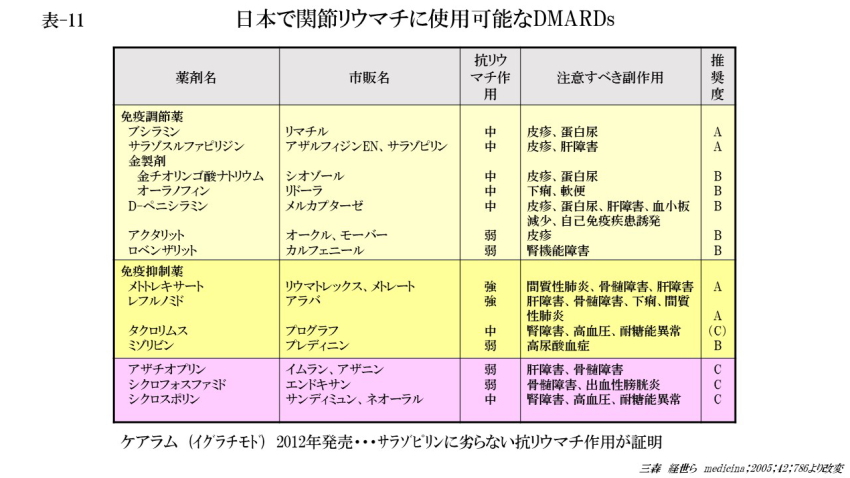
本邦で使用可能なDMARDではMTXが推奨度Aですが、その他リマチル、アザルフィジンも推奨度Aになっています。また2012年から発売されたケアラム(イグラチモド)は、Bリンパ球に直接作用しIgGやIgMといった免疫グロブリンの産生を抑制し、また単球/マクロファージに作用し、TNFα、IL-1β、IL-6などの炎症性サイトカインの産生を抑制することで、抗リウマチ作用を発揮します。これらの作用は、炎症性サイトカインや免疫グロブリンのmRNA 発現低下を伴っており、転写因子NFκBの活性化抑制を介した作用であることが示唆されています。このような作用が免疫抑制的な作用や抗炎症作用の発現につながり、結果として関節リウマチ患者でみられる過剰な免疫応答や炎症・疼痛反応を抑制するものと考えられています。しかし、妊婦、妊娠の可能性のある患者や重篤な肝障害、消化性潰瘍のある患者、ワーファリンを内服中の患者では禁忌となっています。

日本でリウマチに使用可能な生物学的製剤一覧です。レミケードはMTX併用が必須ですが、その他の生物学的製剤は単独使用も可能で、MTXが使いにくい症例で使用することができます。またレミケード以外は皮下注製剤があり、点滴がしにくいクリニックでは処方がしやすくなっているため、今後処方症例が増えることが考えられます。
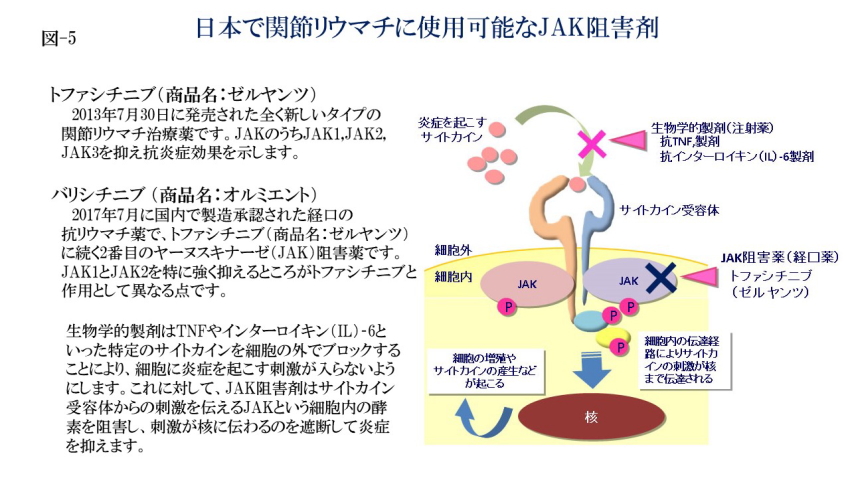
ゼルヤンツは、2013年7月30日に発売された全く新しいタイプの関節リウマチ治療薬で、JAK(ヤヌスキナーゼ)阻害薬と呼ばれる経口の薬です。関節リウマチでは、炎症が起きている関節のなかに白血球など免疫に関与する細胞が多数みられます。サイトカインという物質が、これらの細胞の表面にあるサイトカイン受容体に結合すると細胞に刺激が入り、その刺激は細胞内のシグナル伝達経路によって細胞の中心にある核まで伝わります。その結果、細胞は活性化して増殖したり、自らも炎症を起こすサイトカインなどの物質をつくったりするようになります。現在、広く使われている生物学的製剤はTNF-αやインターロイキン(IL)-6といった特定のサイトカインを細胞の外でブロックすることにより、細胞に炎症を起こす刺激が入らないようにします。これに対して、ゼルヤンツはサイトカイン受容体からの刺激を伝えるJAKという細胞内の酵素を阻害し、刺激が核に伝わるのを遮断して炎症を抑えます。
オルミエントは2017年7月に国内で製造承認された経口の抗リウマチ薬で、トファシチニブに続く2番目のJAK阻害薬です。トファシチニブがJAKのうちJAK1,JAK2,JAK3を抑えるのに対して、バリシチニブはJAK1とJAK2を特に強く抑えるところが作用として異なる点です。この薬剤は腎臓から排出されるため、腎臓の機能が低下している場合には減量する必要があり、また腎臓の機能が高度に低下している場合には使用することができません。
このように関節リウマチの薬物治療の選択肢は格段に拡がっています。
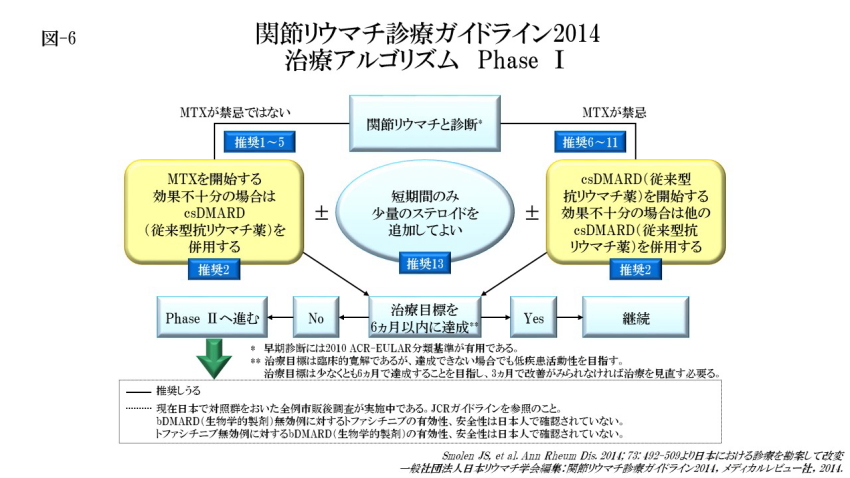
関節リウマチ診療ガイドライン2014では、治療アルゴリズム Phase Ⅰで、ⅰ.csDMARD(従来型抗リウマチ薬)の治療は、診断が下ればできるだけ早く始めるべきである。ⅱ.すべての患者において、解あるいは低疾患活動性を目指して治療すべきである。ⅲ.高疾患活動性の患者では,患者評価を頻回(1〜3ヵ月ごと)に行うべきである。もし治療開始後3ヵ月以内に改善がみられない場合、または6ヵ月以内に治療目標が達成できない場合は、治療を再考すべきである。と定めています。
MTXは,活動性RA患者に対する最初の治療手段の1つに含めるべきである(推奨 1〜5)と、第一選択薬とすべきであると推奨しています。しかし、MTXが禁忌であるか、早期に使えなくなった場合は、サラゾスルファピリジンなど他の csDMARD(従来型抗リウマチ薬)を最初の治療手段の1つに含めるべきでありますが、レフルノミドは日本人における副作用発現のリスクを十分に勘案し、慎重に投与することを推奨しています(推奨 6〜11)。
DMARD未使用の患者さんでは、ステロイド使用の有無にかかわらずcsDMARD(従来型抗リウマチ薬)を単剤で開始すべきであり、有効性が得られない場合は他のcsDMARD(従来型抗リウマチ薬)を追加して併用療法を考慮することを推奨しています(推奨1, 2, 6〜11)。
また、低用量ステロイドは、1つまたはそれ以上のcsDMARD(従来型抗リウマチ薬)と併用していれば、最初の治療手段の1つとして治療開始後6ヵ月までは考慮すべきでありますが、臨床的に可能なかぎり早期に減量すべきであるとされています(推奨 13)。
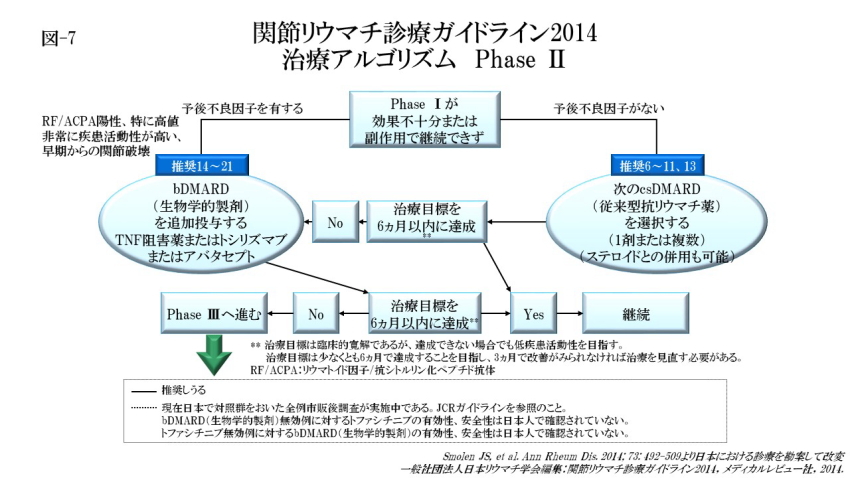
治療アルゴリズム Phase Ⅱでは最初のcsDMARD(従来型抗リウマチ薬)治療により治療目標が達成できない場合、予後不良因子がなければ他のcsDMARD(従来型抗リウマチ薬)への変更を考慮し、予後不良因子があればbDMARD(生物学的製剤)の追加併用を考慮すべきであるとされています(推奨 2〜4, 14〜21)。
MTX単独または他のcsDMARD(従来型抗リウマチ薬)による治療戦略で十分な効果が得られない患者に対しては,ステロイド使用の有無にかかわらず、,bDMARD(生物学的製剤)(TNF阻害薬,アバタセプト、トシリズマブ)をMTXとともに開始すべきであると推奨しています(推奨 14〜21)。
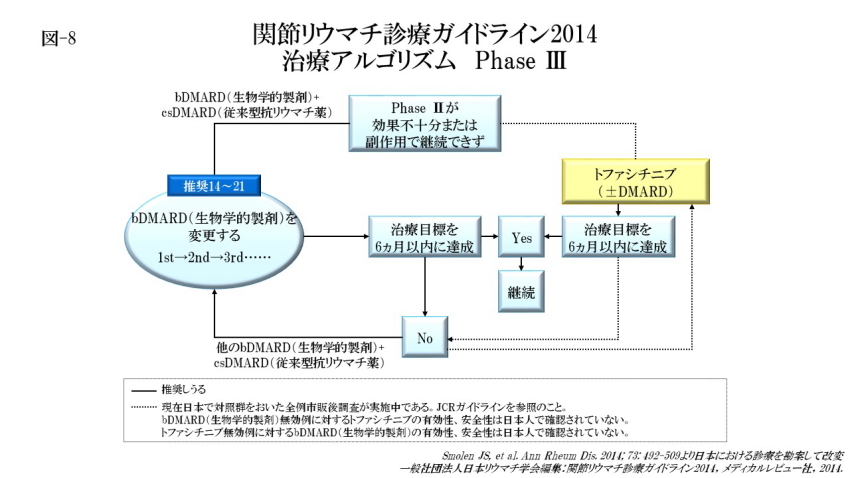
治療アルゴリズム Phase Ⅲでは、最初のbDMARD(生物学的製剤)が奏効しない場合は,他のbDMARD(生物学的製剤)を使うべきで、最初のTNF阻害薬が奏効しない場合は,別のTNF阻害薬または作用機序の異なるbDMARD(生物学的製剤)を使ってもよいと推奨しています(推奨14〜21)。
トファシチニブはbDMARD(生物学的製剤)治療が奏効しない場合の選択肢として推奨しています。bDMARD(生物学的製剤)投与中の患者さんで、ステロイドを減量後も寛解が維持できていれば、 特にcsDMARD(従来型抗リウマチ薬)併用例の場合にはbDMARD(生物学的製剤)の減量を考慮できます。長期間寛解が維持できれば,患者さんと医師の意思共有のうえでcsDMARD(従来型抗リウマチ 薬)の投与量を慎重に減量することを考慮してよいと推奨しています。また、治療を再考する場合に、疾患活動性以外の要素、構造的破壊の進行、合併症、安全性に関わる 問題なども考慮すべきであるとも推奨しています(推奨 36, 37)。
治療効果の評価
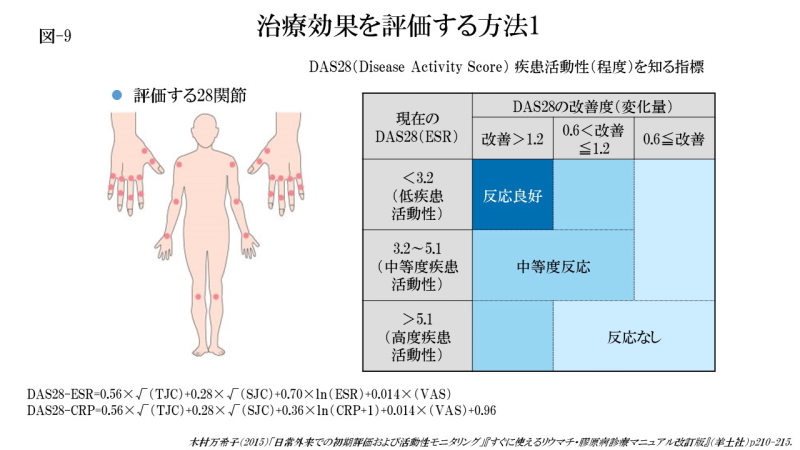
治療効果を評価する方法の一つとして、疾患活動性スコア(disease activity score:DAS)が用いられています。DASはEULARが提唱した関節リウマチにおける疾患活動性を数値化した指標で、患者さんの痛みの訴えだけでなく、関節の状態と血液検査を組み合わせ、関節リウマチの症状の強さを総合的に評価して、具体的な数値として表すものです。
DASには44関節を用いるオリジナルのDAS44と、簡便化して28関節を用いて評価するDAS28があります。特にDAS28は実臨床における疾患活動性の評価による臨床的寛解基準の指標として高い頻度で使用されます。
DASの算出は、圧痛関節数、腫脹関節数、患者による全般的健康状態(Visual Analog Scale:VASにより0~100mmで評価)、血沈値(ESR、mm/時間)の4項目を計算式に代入して算出し、算出された数値から、寛解、低疾患活動性、中疾患活動性、高疾患活動性の4段階で判断します。
なお、DAS28はESRの代わりにCRP(mg/dL)が使用されることもあります(計算式が異なります)。さらに、4項目でなくVASを除いた3項目を用いることもあります。
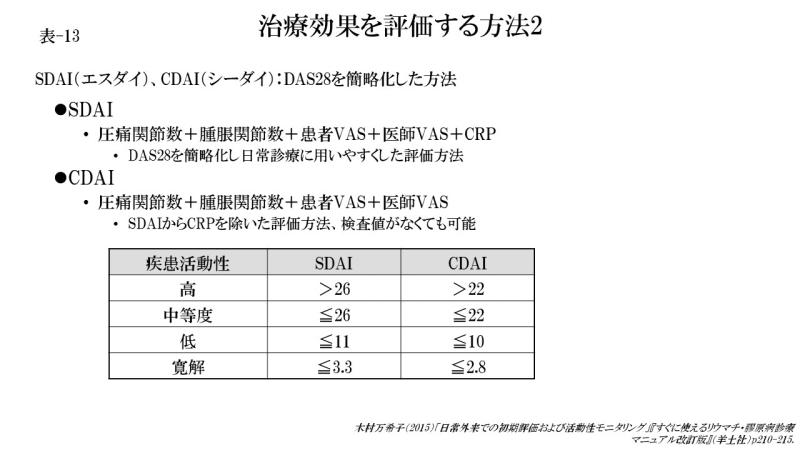
臨床的寛解を評価するもう1つの方法として、CDAI (clinical disease activity index、シーダイ)とSDAI(simplified disease activity index、エスダイ)が用いられます。
CDAIは関節の評価と患者および医師による患者の全般的疾患活動性(Visual Analog Scale:VASにより0~100mmで評価)により評価し、SDAIはCDAIにCRPの値を加えて評価します。
いずれもDAS28よりも簡便に計算できる評価指標です。
計算の結果出された数字をみて疾患活動性の状態を把握することができます。

関節の状態とは別に、全身の機能障害の程度を知る方法として、Steinbrocker(スタインブロッカー)機能分類が有名です。
この分類は4つに分かれており、病気の進行度合いを、日常生活(ADL)の動作がどの程度行えるかにより評価します。

近年、関節リウマチ診断・治療の大きな進歩により、早期診断、早期治療が可能になり、寛解を目指せるようになってきています。
ACR/EULARが2011に発表したRA寛解基準は確定したものではありませんが、暫定的に示された基準で、日常臨床における基準と臨床試験における基準に分けられています。
日常臨床における基準は、3つの評価(寛解は、圧痛関節数≦1ヵ所、腫脹関節数≦1ヵ所、患者の全般評価 VAS≦1/10のすべてを満たす)で判定するBoolean法(booleanは「0または1」という意味)またはCDAI (clinical disease activity index、寛解≦2.8)により評価します。
臨床試験における基準は、Boolean法にCRP≦1を追加して4つの基準を満たす場合に寛解とし、あるいはSDAI(Simplified Disease Activity Index)≦3.3を寛解と判定します。
この基準は、将来的に臨床的寛解だけでなく、構造的寛解、機能的寛解の3つの寛解を満たす「真の寛解」を目指すもので、これまでのDAS28による臨床的寛解よりも厳しい基準です。
関節リウマチ治療でめざす寛解とは
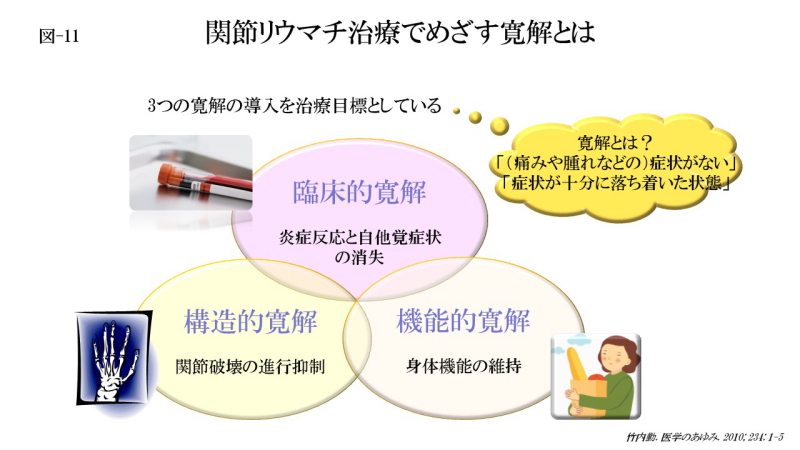
寛解とは痛みや腫れなどの症状がない、症状が十分に落ち着いた状態をいいます。寛解については、炎症反応と自他覚症状の消失(臨床的寛解)、関節破壊の進行抑制(構造的寛解)および関節機能や生活動作の維持(機能的寛解)という、いわゆる3つの寛解を達成することが重要であり、関節リウマチ治療における最終的な治療目標になります。
患者・家族への日常生活の注意点

関節リウマチの治療法はどんどん進歩しています。ただし、治療が順調で、症状が軽くなっても、関節を大事にして、感染症を予防することは大切であり、常に体調管理には気をつけることが大切です。
拘縮を防ぐために適度な運動を行い、食事や睡眠、ストレスをためない生活を心がける、禁煙する、感染予防のため予防接種を受けるなど、日常生活ではいくつかの注意が必要です 。
また、感染症の一つとして、ペットによる傷、虫刺されから蜂窩織炎に移行するリスクがあります。
このように医療者側からだけでは気が付かない事もより患者さんに身近な家族が気付いてあげられることもありますし、患者さんの療養をサポートする家族の力は重要です。
患者さんや家族が疾患について、また日常生活の留意点を十分理解して、家族のサポート得られるように家族を含めた指導をしていくことが大事です。











